Серьезные статьи Кирквуда и других выдающихся ученых вскрывают парадоксы старения.
Источником этих парадоксов служит предположение, что старение вызвано случайными накапливающимися молекулярными повреждениями. В статье я показываю, что концепция «запрограммированного» старения, вызываемого ТОR, практически автоматически разрешает одиннадцать парадоксов старения.
В статье обсуждается, почему накопление молекулярных повреждений не ограничивает продолжительность жизни, почему низкокалорийная диета и торможение синтеза белков увеличивают продолжительность жизни, почему несуществующая «программа» старения, тем не менее, устойчива к сбоям, почему ключевой ген старения нельзя обнаружить путем сепарации, почему низкое содержание инсулина ассоциируется с хорошим здоровьем, а низкая чувствительность к инсулину – с плохим, почему старение не является заболеванием, но его можно лечить как болезнь, почему «здоровое» старение – это медленное старение, и почему мы считаем, что низкокалорийная диета действительно замедляет старение человека.
Американский биогеронтолог Михаил Благосклонный полагает, что старением управляет квазипрограмма, являющаяся бессмысленным побочным следствием реализации генетически запрограммированного индивидуального развития. После своего выполнения программа развития выключается не полностью, и эта своеобразная «инерция» приводит к разрушительным последствиям.
Образно выражаясь, перестав расти в высоту, человек начинает расти в ширину. Старение начинается с гиперфункции на клеточном уровне. В старой, больше не делящейся клетке активизируются процессы синтеза белков, регулируемые особыми ферментами, роль которых в ходе развития заключалась в организации роста и деления клеток.
Клетка увеличивается в размерах, синтезирует больше белка и подает сигналы к росту соседним клеткам. Когда старых клеток много, функции ткани, состоящей из них, изменяются. Не изнашивание, а болезненное разрастание и гиперфункция клеток вызывают атеросклероз, ишемию, инфаркты миокарда и инсульты, остеопороз и другие возрастные заболевания. Недаром ограничительная диета, за счет которой снижается рост численности старых клеток, способствует долголетию.

Введение
Согласно современному определению, старение это ухудшение состояния, в результате накопления случайных молекулярных повреждений, вызванных свободными митохондриальными радикалами (или другими повреждающими факторами).
Вопрос заключается в том, почему соматические клетки (клетки тела) и многоклеточные организмы не могут восстанавливать себя, в то время как зародышевые клетки и большинство одноклеточных организмов (хотя и не все) могут. Чтобы разрешить этот парадокс было выдвинуто предположение, что организм может лечить молекулярные повреждения, но у него нет необходимости вылечивать их на 100%. Соматические клетки должны оставаться неповрежденными так долго, сколько организм сможет просуществовать во враждебной среде.
Организм перебрасывает ресурсы с восстановления на размножение и другие жизненно важные функции.1 (Замечание: Чтобы избежать путаницы введем понятие омолаживающее восстановление молекулярных повреждений, исходя из теории о том, что молекулярные повреждения вызывают старение. В отличие от этого, жизненно важная профилактическая работа, такая как обновление РНК и белков, трансмембранный потенциал, регенерация крови и клеток эпителия (и это далеко не полный список) позволяет избежать немедленной смерти. По логике, ресурсы в первую очередь должны быть брошены на жизненно важную профилактику (чтобы не допустить мгновенной смерти), излишки могут быть направлены на размножение и рост и только после этого на омолаживающее восстановление).
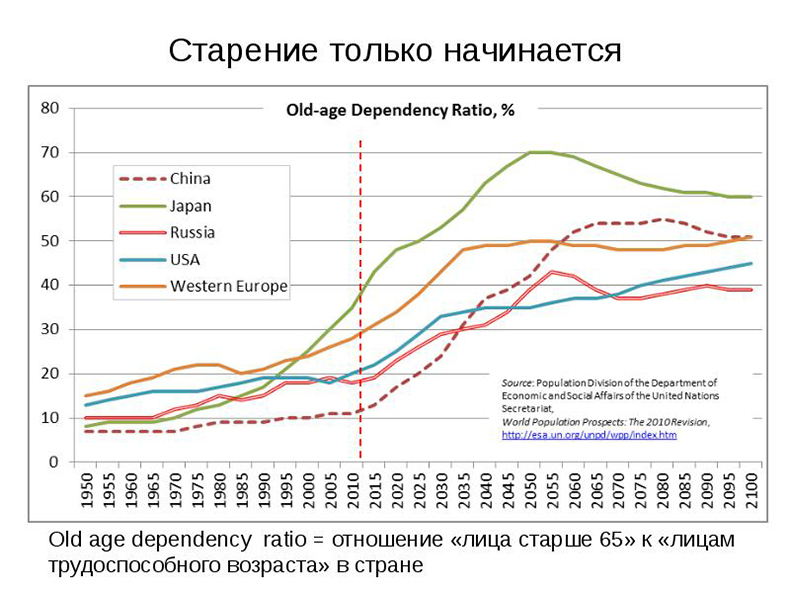
В дикой природе пищи много не бывает, и животные выживают за счет того, что вкладывают все свободные ресурсы в экстренное выживание и размножение, а не в способность лучше восстанавливаться, даже несмотря на то, что это означает, что повреждения будут накапливаться, вызывая старение.1 Это должно означать, что усиленное потребление калорий позволит организму больше ресурсов использовать как для размножения так и омолаживающего восстановления, увеличивая таким образом продолжительность жизни. (Замечание: Здесь читатель может не согласиться и вместо этого предположить, что изобилие пищи приведет к тому, что организм будет больше вкладывать в размножение, тем самым развивая «стареющий» фенотип, то есть укорачивая продолжительность жизни. Из этого следует, что старение является побочным продуктом размножения, а значит полностью опровергается утверждение, что старение это накопление молекулярных повреждений. Поэтому давайте строго следовать теории Кирквуда, что старение это накопление незалеченных (в силу нехватки ресурсов) молекулярных повреждений, без неявного использования идей о том, что старение схоже с генетический программой).
Другим выводом, следующим из теории размещения сил, является то, что снижение калорийности должно вести к перераспределению ресурсов с борьбы со старением в пользу жизненно важной профилактики, роста и размножения. И, если накопленные молекулярные повреждения являются причиной старения, тогда животные должны быстрее стареть. Однако реальность не совпадает с прогнозами.
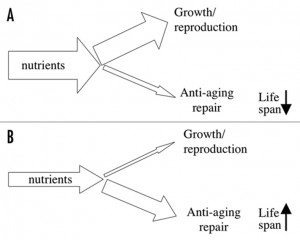
Схема 1. Парадокс размещения ресурсов при низкокалорийной диете. Все ресурсы, полученные из питательных веществ, делятся между жизненными функциями, ростом и размножением с одной стороны и омолаживающим восстановлением с другой стороны. (А) Ресурсы в первую очередь должны направляться на жизненно важные функции, рост и размножение и только затем на омолаживающее восстановление. (В) Парадоксально, снижение калорийности замедляет старение, бросая все ресурсы на восстановление.
Парадокс 1: Парадокс размещения ресурсов
Предполагается, что организм делит ресурсы между восстановлением, размножением и незамедлительной борьбой за жизнь.1,2 Питательные вещества дают энергию для всех этих процессов, включая омолаживающее восстановление. По логике, чем больше питательных веществ, тем больше калорий может быть потрачено на восстановление (Сх. 1А). Однако переедание (или если животное наедается до отвала) укорачивает продолжительность жизни.
Низкокалорийная диета (снижение объемов съедаемого на 30-40% без недокорма) увеличивает продолжительность жизни и замедляет процессы старения у различных видов живых существ начиная с дрожжевых грибков и червей и кончая крысами и мышами. У некоторых видов встречаются некоторые исключения, возможно, что несбалансированная низкокалорийная диета ведет к недоеданию, и тем самым маскирует эффект роста долголетия за счет снижения калорийности. Но так или иначе, но любая теория, которая предсказывает, что увеличение калорийности потребляемой пищи увеличит продолжительность жизни, должна быть без сомнений отвергнута.
Для защиты модели распределения сил был высказано предположение, что, снижая репродуктивность, нехватка пищи вызывает усиление восстановления (Сх. 1В). Замедление старения позволяет увеличить вероятную продолжительность жизни и дает возможность заняться размножением позже, когда голодный период закончится. Отложенное старение представляет собой «стратегию выживания в голодные годы».2 Это парадоксально. Давайте рассмотри некую аналогию. Представьте, что вы делите вашу зарплату, чтобы оплатить квартиру и другие ваши потребности.
Если Вас уволили с работы, переедете ли вы в шикарную квартиру, полностью отказавшись от всех ваших других потребностей? Или наоборот, вы, возможно, станете присматривать менее дорогое жилище. Так и усиленное омолаживающее восстановление (чтобы замедлить старение) является роскошью, особенно в периоды голода. Скорее наоборот, разумной биологической стратегией было бы прекратить борьбу со старением и бросить все силы на насущные потребности и размножение.
Парадокс 2: Парадокс регулируемого старения
Гипотеза, что ограничение калорийности вызывает перераспределение ресурсов в пользу омолаживающего восстановления, чтобы дать возможность организму жить дольше и позже размножиться, ведет к еще более причудливому парадоксу. Согласно эволюционной теории, замедление старения не способно увеличить шансы выжить в дикой природе, так как животные гибнут от внешних причин (хищники, болезни, голод), задолго до того, как состарятся. Нет нужды в более совершенном восстановлении, так как жизнь ограничена смертью от случайных причин. Гипотеза распределения ресурсов позволяет сделать вывод, что улучшенное омоложение может увеличить продолжительность жизни в дикой природе.
Другими словами, гипотеза распределения противоречит эволюционной теории старения. Кроме того, перераспределение ресурсов за счет размножения в пользу борьбы со старением уменьшит число потомков. Эта стратегия будет уничтожена процессом естественного отбора. Этот парадокс был замечен: «Не является очевидным, что благо замедления присущего данному виду процесса старения, в состоянии само по себе дать дополнительные преимущества за счет лучшей физической формы, в условиях, когда основная часть популяции обычно не доживает до старости».
Также, если организм в состоянии замедлить старение во время нехватки пищи, то это означает, что он предпочитает намеренно не делать этого в обычных условиях. А из этого следует существование программы старения. И вот новый парадокс. Модель распределения ресурсов была предложена специально чтобы доказать, что старение не запрограммировано. Но прежде чем решим эту головоломку, давайте рассмотрим два родственных парадокса.
Парадокс 3: Парадокс синтеза протеинов
Старение связано со снижением синтеза протеинов. Естественно ожидать, что дальнейшее замедление процесса синтеза протеинов снизит продолжительность жизни. Парадоксально, но замедление трансляции иРНК и синтеза протеинов ведет к увеличению продолжительности жизни у червей C. Elegans. Чтобы объяснить эти результаты, два взаимоисключающих состояния (рост и восстановление) были введены в уже изложенную теорию. Замедление синтеза протеинов, как и снижение калорийности питания, приводит клетки в физиологические состояния, благоприятствующие омоложению. Однако из этого следует, что когда организм не растет (по завершению процесса развития), то он в состоянии перенаправить ресурсы на восстановление молекулярных повреждений и устранение старения. Но это следствие не выполняется: старение заявляет о себе, как только организм перестает расти (по завершению процесса развития).
Парадокс 4: Генетическая программа или неуклонно выполняется или не существует
Инактивация (подавление активности) многочисленных генов увеличивает (гены старения) и уменьшает (гены долголетия) продолжительность жизни. Как считает Кирквуд, если гены и программируют старение, то делают они это очень приблизительно. Существует значительный разброс в продолжительности жизни генетически идентичных червей в одной и той же обстановке. Это совершенно не похоже на процесс, который регулируется с такой большой точностью.
Хотя уже обнаружены сотни мутаций, которые ведут к увеличению продолжительности жизни C. elegans, однако не было найдено такой комбинации мутаций, которая бы полностью исключала старение. А это означает, что или программа старения исключительно устойчива к внешним воздействиям или ее не существует. Так что, она неуклонно выполняется или ее не существует? Как мы покажем ниже, и то и другое. Нечто похожее на программу «исключительно устойчиво», хотя программы не существует.
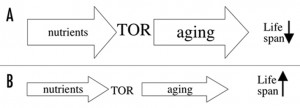
Схема 2. Решение парадокса низкокалорийной диеты. Снижение калорийности не ведет к направлению всех ресурсов на борьбу со старением. Вместо этого связь между питательными веществами и старением носит чисто механистический характер. (А) Питательные вещества активизируют TOR (target of rapamycin), который ускоряет старение. (В) Низкокалорийная диета снижает активность TOR, что ведет к увеличению продолжительности жизни.
Дилемма: Случайность или программа
Многие согласны с тем, что старение не запрограммировано и его вызывает накопление молекулярных повреждений под воздействием свободных радикалов или активных форм кислорода (ROS). Однако практика и подтверждает теорию ROS – старения и противоречит ей. Следствия из теории ROS не совпадают с многочисленными наблюдениями: животных можно клонировать из старых клеток, накопление мутаций не обязательно должно превысить значительный уровень для того чтобы началось старение, использование антиоксидантов при клинических исследованиях не привело к увеличению продолжительности жизни.
Не согласующиеся результаты опровергают теорию. И что важно, результаты, положенные в основу теории ROS-старения имеют другое возможное объяснение, хотя об этом будет сказано в другой работе (Благосклонный, «Старение: ROS или TOR», подготавливаемой к выпуску). Старение и болезни, связанные с ним, похожи на программы, хотя и не являются программами в полном смысле слова.Хотя кажется, что генетический контроль за старением говорит в пользу некой программы.
Однако с эволюционной точки зрения не может существовать специальной программы, вызывающей упадок и смерть. «Теория эволюции подсказывает, что старение вызвано не программированием активных генов, а развившимися ограничениями в профилактике соматических дефектов, которые ведут к нарастанию нарушений. Чтобы понять клеточную и молекулярную основу старения, необходимо разобраться в многочисленных механизмах, заставляющих повреждения накапливаться, и в сложной структуре систем, следящих за тем, чтобы повреждения не вредили здоровью».
И так кажется, нам надо принять теорию развития старения в результате накопления случайных повреждений, ведь программа старения не может существовать. Но случайные повреждения не являются единственной альтернативой программе. Настоящей альтернативой служит квази-программа, являющаяся продолжением программы.
Квазизапрограммированное старение вызванное TOR
Как было недавно установлено, квази-программа старения это непредусмотренное продолжение программы развития.34 Для аналогии, если вы оставите открытым водопроводный кран после принятия ванны, то «программа» наполнения ванны превратится в «квази-программу» затопления вашей квартиры. В отличие от программы у квази-программы нет цели (а значит она не противоречит эволюционной теории).
У домашних и лабораторных животных и у человека квазизапрограммированное старение определяет продолжительность жизни (Сх 3В). В дикой природе немногие доживают до окончания фазы развития и очень немногие умирают от квазизапрграммированного старения. (Сх 3А). В качестве непредусмотренного продолжения программы развития квази-программа не отличается большой точностью. Это находится в полном соответствии с парадоксом IV, установленным Кирквудом, — «если гены и программируют старение, то делают они это очень приблизительно. Это составляет полную противоположность процессу развития, который исключительно точно расписан.
Приблизительное регулирование — это именно то, чего можно ждать от квази-программы. Второе, был сделан вывод, что «или программа старения исключительно устойчива к внешним воздействиям или ее не существует».16 На самом деле программы старения не существует (это продолжение программы развития). Эта программа исключительно устойчива, так как отключить ее можно только на генном уровне, отключив программу развития (а это ведет к смерти).
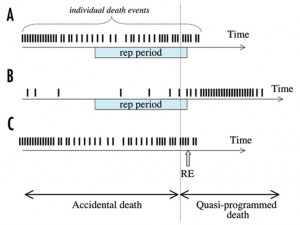
Схема 3. Парадокс тихоокеанской семги. Короткие вертикальные линии показывают смерть отдельных особей (индивидуальная смерть). (А) В дикой природе животные гибнут от случайных смертей. Только немногие умирают от старости после периода размножения. (В) Люди, домашние и лабораторные животные. Из-за снижения доли случайных смертей, квазизапрограммированное старение отмечается у большинства особей, которые теперь умирают от старости (а точнее от возрастных заболеваний). (С) Тихоокеанская семга. В дикой природе очень немногие животные умирают от старости после одного репродуктивного эпизода (RE). Большинство особей гибнет от случайных смертей, таким образом тихоокеанская семга не является исключением (сравните А и С).
Объяснение парадоксов 1-4
Парадокс 1. Когда пищи не хватает, организм парадоксальным образом направляет энергетические ресурсы на исправление молекулярных повреждений, чем объясняется, почему низкокалорийная диета (CR) продляет жизнь (Сх. 1) Решение: TOR является датчиком питательной среды. Питательные вещества активизируют TOR (target of rapamycin), тем самым ускоряя старение (Сх 2А). И наоборот, недостаток питательных веществ снижает активность TOR, увеличивая продолжительность жизни. Таким образом, снижение калорийности (CR) должно замедлять процесс старения. (Сх 2В)
Парадокс 2. Парадокс регулируемого старения. Решение: CR увеличивает продолжительность жизни не для любых целей, не для того чтобы жить дольше. Просто TOR, на который воздействуют питательные вещества, ускоряет и рост и старение.
Парадокс 3. Хотя синтез протеинов с возрастом снижается, замедление синтеза протеинов продляет жизнь. Решение: В первую очередь ингибиция рибосомных белков, S6 киназы или факторов инициации трансляции (eIF4G и изоформы eIF4E) снижает синтез белков и продляет жизнь у C. elegans.4‑6 Все эти факторы трансляции являются последовательными целями для TOR на пути метаболизма TOR. Иными словами, противодействие транскрипции TOR продляет жизнь в полном соответствии с предсказаниями теории старения, вызываемого TOR.
Парадокс 4. Программа старения или неуклонно выполняется или не существует. Решение: Программа старения в чистом виде не существует, но является продолжением программы развития, которая неуклонно выполняется.
Парадокс 5: Парадокс семги.
Общеизвестно, что старение тихоокеанской семги запрограммировано. И тем самым оно отличается от незапрограммированного старения, например, дикой мыши. Утверждается «старение, за исключением исключительных случаев, таких как быстрая деградация и смерть тихоокеанской семги, является не «проектным решением», а упадком» и «Для большинства особей, отличных от похожих на тихоокеанскую семгу, где смерть совпадает непосредственно с окончанием одного-единственного репродуктивного цикла, нет серьезных оснований считать, что старение вносит заметный вклад в смертность в дикой природе».
Парадокс заключается в том, что хотя запрограммированное старение невозможно с теоретической точки зрения, предполагается, что некоторые особи, включая тихоокеанскую семгу, демонстрируют запрограммированное старение. Однако же, если запрограммированное старение и смерть возможны для некоторых видов, то теоретически нельзя исключать запрограммированное старение и смерть для любого вида.
Модель квазизапрограммированного старения разрешает этот парадокс. В большинстве практических применений квази-программа действует как некая программа. Однако между ними есть заметное различие. Если старение для семги является программой, то она в дикой природе должна умирать от старости. Если старение является квази-программой, то большинство особей в дикой природе должно умирать до того как начинается квазизапрограммированное старение. Именно благодаря этому можно программу отличить от квази-программы. Например мыши (как и большинство других видов) редко умирают от старости в дикой природе (Сх 3А).
Сценарий, показанный на схеме 3А, соответствует квази-программе. Старение для мышей является квази-программой, что означает, что в дикой природе оно не важно (Сх.3А), но в лабораторных условиях оно становится заметным (Схг 3В). Так как же семга? Все (включая меня) так или иначе повторяют, что тихоокеанская семга неизменно умирает сразу после первого и единственного репродуктивного эпизода (нереста). В реальности тихоокеанская семга почти неизменно погибает еще до размножения от случайной смерти (Сх 3С).
Более 99% процентов рыб погибает до момента размножения, в то время как менее 0,2% особей умирают от старости после нереста (Сх 3С). На самом деле у самки семги 1000-2000 икринок. И достаточно, чтобы только одна самка дожила до размножения, чтобы популяция сохранилась. Таким образом только одна из сотен рыб умирает после размножения от старости. А значит тихоокеанская семга не является исключением. Как и у других животных, большинство особей тихоокеанской семги гибнет от случайных причин, и лишь несколько выживших умирают от квазизапрограммированного старения. Старение играет несущественную роль в дикой природе не только для мышей, но и для тихоокеанской семги.
Парадокс 6: Парадокс антагонистической плейотропии
Гены антагонистической плейотропии являются целебными в молодом возрасте, но позже вызывают старение. Как предполагает Кирквуд, «одной из проблем такого взгляда, тем не менее, является то, что на самом деле существует очень мало несомненных примеров существования кандидатов на роль генов плейотропии помимо p53.16 На самом деле p53 является сложным примером гена антагонистической плейотропии. Теоретически, животные, у которых отсутствует какой-либо ген антагонистической плейотропии, в раннем возрасте должны иметь недостатки, но жить должны дольше. Этому противоречит тот факт, что мыши, у которых отсутствует p53, быстро умирают от рака. А рак это возрастная болезнь.
И низкокалорийная диета и другие условия, замедляющие старение, также отодвигают появление рака.45 У мышей, у которых отсутствует р53, рак появляется в молодом возрасте. С этой точки зрения р53 фактически является геном антистарения. С другой стороны, мыши без гена р53 болеют в раннем возрасте, и животные без гена р53 могут не дожить до того, чтобы можно было проверить, отступило ли старение. Сложность ситуации с р53 у мышей заключается в том, что мыши болеют в раннем возрасте, но страдают от «старческого» заболевания.
Ситуация осложняется тем, что «гиперактивный р53» дает защиту от рака, но ведет к преждевременному старению.47,48 Похоже, что искусственный р53 является геном антагонистической плейотропии, но в природе его не существует. Некоторые другие гиперактивные р53 наоборот продляют жизнь.49 Как кстати было подмечено, те гиперактивные р53, которые ускоряют старение, также усиливают сигналы IGF‑1. А сигналы IGF‑1 активизируют TOR.

Гены, которые регулируют путь метаболизма TOR, являются генами плейотропии. Например, частичная нехватка TOR приводит к остановке развития, которая сопровождается дистрофией гонад, но при этом замедляется старение. И все-таки потеря генов, регулирующих TOR не ведет к бессмертию. Ключевой ген плейотропии может быть очень важным на ранней стадии развития (и потеря ключевых генов, отвечающих за старение, ведет к смерти, иначе бы мы время от времени встречали бессмертных животных).
Что важно, полное отключение TOR ведет к смерти. Например, повреждение гена TOR у мыши ведет к ранней смерти после имплантации.52-54 Квази-программа старения вызванного TOR устойчива к любым воздействиям, так как генетически ее можно отключить, отключив основной (на раннем этапе развития) ген. А это ведет к смерти. Таким образом, гены, чьи мутации могут сделать животное бессмертным, невозможно обнаружить методом отключения подобных генов.
Парадокс 7: Инсулиновый парадокс
Как недавно было заявлено: кажется парадоксальным, что ослабление сигналов инсулина/IGF‑1 продляет жизнь, но резистенция к инсулину ведет к появлению диабета 2-ого типа. Настоящий парадокс это почему, в случае с млекопитающими, низкий уровень инсулина ассоциируется с хорошим здоровьем, а ослабленная реакция на инсулин с плохим. Теория квази-программы, запускаемой TOR, дает ответ. Инсулин и IGF‑1 активируют TOR. Таким образом, ослабление сигналов инсулина/IGF‑1 снижает активность TOR и тем самым замедляет старение.
Резистенция к инсулину является проявлением повышенной активности TOR, так как излишне активный TOR вызывает резистенцию к инсулину. Итак в обоих случаях во всем виновата повышенная активность TOR: вызывается ли она инсулином или она проявляется в виде резистенции к инсулину. (Сх 4)
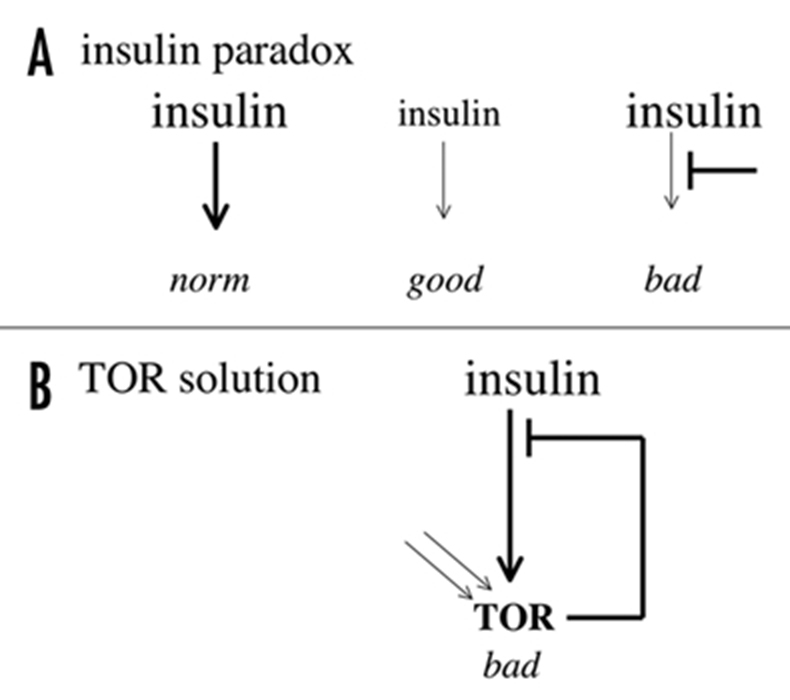
Схема 4. Инсулиновый парадокс.(А) Если говорить об инсулине, то есть парадокс. Низкий инсулин — это «хорошее здоровье», а ослабленный инсулиновый сигнал это «плохо для здоровья». (В) С учетом TOR никакого парадокса нет. Гиперактивный TOR может быть результатом повышенного содержания инсулина, а снижение инсулинового сигнала может являться следствием гиперактивности TOR. В обоих случаях гиперактивность TOR «вредна для здоровья»
Парадокс 8: Меньше значит больше
Согласно классической версии теории свободных радикалов, усиленный кислородный метаболизм митохондрий ведет к усиленному появлению активных форм кислорода (ROS), и тем самым к сокращению продолжительности жизни. Что удивительно и полностью противоречит классической теории, так это то, что, как было обнаружено, чем больше митохондрия работает, тем дольше дрожжевой грибок живет.55,56 Было выдвинуто предположение (противоречащее предшествующим точкам зрения), что усиленное потребление кислорода ведет к замедлению процесса появления новых ROS.
Важно, что для увеличения вентиляции был удален TOR1. Таким образом, альтернативным объяснением является то, что ни скорость притока кислорода, ни появление ROS не сказываются на продолжительности жизни. Другими словами, изменения в ROS могут быть случайными и не имеющими отношения к делу. Что на самом деле важно, так это то, что удаление TOR1 было связано с увеличением продолжительности жизни.
Парадокс 9: Парадокс гормезиса
Гормезис – это продление жизни за счет небольших повторяющихся стрессов. Хронический клеточный стресс, включая появление ROS, может продлить жизнь.57 Было высказано предположение, что благоприятный эффект физических упражнений частично вызван появлением ROS.57 Стандартное объяснение – небольшое молекулярное повреждение активизирует механизмы их исправления.
Это крайне парадоксально, что когда, как считается, старение вызывается накоплением молекулярных повреждений, любое дополнительное повреждение может замедлить старение. Простейшим ответом является то, что не случайные повреждения, а квази-программа, запускаемая TOR, вызывает старение. Небольшой стресс оказывает замедляющее действие на путь метаболизма TOR.
Парадокс 10: Старение как заболевание
Является старение заболеванием или нормой? С одной стороны, старение это – заболевание, так как увеличивает вероятность смерти. С другой стороны, « старение это не заболевание, а нормальная часть жизненного цикла».60 Более того, никто не умирает от здоровой старости как таковой. Все умирают от возрастных заболеваний, таких как атеросклероз, рак, диабет, остеопороз и т.д.
Источником парадокса является предположение о том, что старение и возрастные заболевания вызываются независимыми причинами (Сх 5А). То есть считается, что старение вызывается свободными радикалами и накоплением молекулярных повреждений, в то время как возрастные заболевания появляются по другим причинам. Например, диабет 2-ого типа является проявлением резистенции к инсулину. Резистенция к инсулину не является проявлением накопления молекулярных повреждений. Резистенция к инсулину вызывается TOR.
Таким образом, идея квази-программы старения, запускаемой TOR, разрешает этот парадокс. Путь метаболизма TOR участвует как в процессе старения, так и в возрастных заболеваниях. (Сх 5). Возрастные заболевания – это суть смертельные проявления старения. Хотя старение не является болезнью, его можно замедлить с помощью фармакологического воздействия. Это может отодвинуть появление всех возрастных заболеваний. Это положение полностью противоречит мнению, что «называть старение болезнью и пытаться вылечить его – это антинаучно, и сбивает с правильного пути». Хотя старение и не является болезнью в полном смысле слова, его можно лечить.
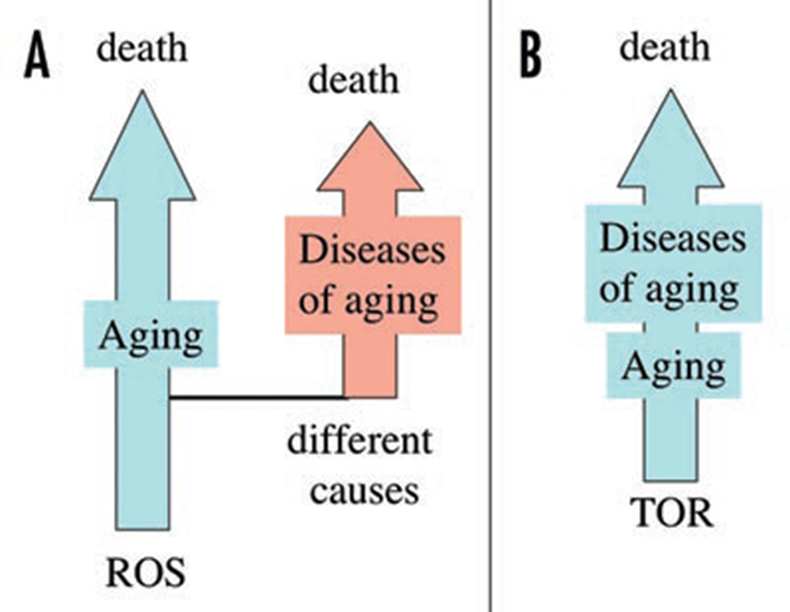
Схема 5. Старение и заболевания (А) Парадокс: У старения и возрастных заболеваний разные причины. ROS вызывает старение, а другие процессы вызывают возрастные заболевания. Старение усиливает предрасположенность к заболеваниям, что приводит к смерти. И даже старение без заболеваний (здоровая старость) ограничивает продолжительность жизни. Можно ли умереть от здоровой старости? Является ли старость заболеванием? (В) Решение: Гиперактивный TOR ускоряет процесс старения, что частично проявляется в возрастных заболеваниях. Возрастные заболевания ведут к смерти, но они являются изменчивыми проявлениями процесса старения. Здоровое старение это медленное старение.
Парадокс 11: Парадокс здорового старения
Возможно ли здоровое старение? Может ли человек стареть, оставаясь здоровым (без заболеваний)? Что в результате станет причиной его смерти (если не брать внешние угрозы)? Если ничто не вызывает смерть, то и старения нет. И наоборот, если старение будет остановлено, но человек будет страдать от возрастных заболеваний, то увеличения продолжительности жизни не произойдет. В основе парадокса лежит идея о том, что старение является разрушительным процессом, который делает человека беззащитным по отношению к так называемым возрастным заболеваниям. Что подразумевает, что старение вызывается одними причинами, а болезни – другими. (Сх. 5А)
Согласно теории квазизапрограммированного старения, и у старения и у возрастных заболеваний одни и те же причины. На начальном этапе вызываемое TOR старение является не разрушением, а излишне активным функционированием, которое может вызвать повреждения. Возрастные заболевания – это признаки старения, как дым – признак огня. Замедление старения одновременно продлит жизнь и отодвинет возрастные заболевания. Здоровое старение (старение без заболеваний) это просто медленное старение.
Низкокалорийная диета (CR) продляет жизнь человека.
Низкокалорийная диета (CR) продляет жизнь и отодвигает появление возрастных заболеваний у целого ряда биологических видов, включая крыс, мышей, рыб, мух, червей и дрожжевой грибок.65 Как рассмотрено в парадоксе 1, омолаживающий эффект CR трудно увязать с теорией ROS. Поэтому про феномен CR обычно говорят, что у человека он не работает. Как следует из названия одного обзора низкокалорийная диета вряд ли продлит жизнь человека.66 Правда, в статье не приводится ни одного доказательства в защиту этого тезиса.
Действительно, в отличие от грызунов, люди мало подходят для экспериментов, длящихся всю жизнь. Однако в таких экспериментах нет необходимости. Клиническая статистика заболеваемости и смертности среди тучных, страдающих излишним весом и стройных взрослых людей показывает, что CR увеличивает продолжительность жизни у людей. Точно так же нет необходимости проводить клинические исследования среди курящих и некурящих, чтобы выяснить, что курение повышает риск рака легких.
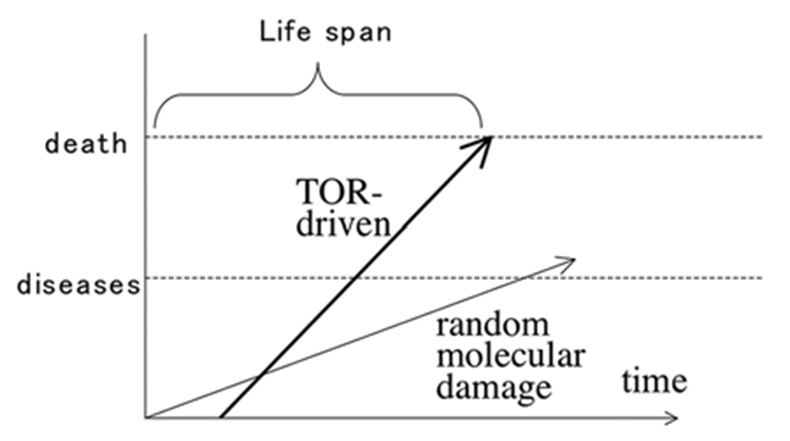
Схема 6. Почему накопление случайных молекулярных повреждений не ограничивает продолжительность жизни. Накопление случайных молекулярных повреждений начинается в день самого рождения. В принципе это вызовет заболевания и смерть. Но все-таки квазипрограммированное старение вызванное TOR в период после окончания развития приведет к заболеваниям и смерти раньше. И всё же накопление случайных молекулярных повреждений способствует появлению некоторых заболеваний, таких как рак.
Вероятно, король Генрих VIII не ограничивал потребление калорий. Но многие люди или выбирают сниженное потребление еды или не в состоянии позволить неограниченное поедание пищи. И можно поспорить, что авторы тезиса «Низкокалорийная диета не увеличивает продолжительность жизни у всех биологических видов, и вряд ли проделает это с человеком» сами ограничивают потребление калорий для того, чтобы чувствовать себя здоровее и жить дольше. Даже незначительное снижение потребления калорий (то есть отказ от переедания в пользу более здоровой диеты) снижает вероятность возрастных заболеваний.
Стареющие взрослые, кто ест столько, сколько захочется, без ограничений, страдают излишним весом, что повышает смертность. С возрастом большинство взрослых накапливает висцеральный (внутренний) жир, а это ассоциируется с возрастными заболеваниями.
Накопление висцерального жира напрямую связано с диабетом, атеросклерозом, тромбозом, гипертонией и другими возрастными заболеваниями. Эти заболевания заканчиваются инсультом и инфарктом миокарда, обрывая жизнь человека.
Даже небольшая потеря веса благоприятна для пожилых людей. Благодаря «отодвиганию» возрастных заболеваний, даже умеренное CR ведет к продлению жизни. Раз мы умираем от возрастных заболеваний, предотвращение заболеваний путем CR должно продлить жизнь. Даже если CR просто помогает избежать сокращения жизни, вызванного тучностью, то CR уже продляет жизнь.
Неограниченное потребление пищи сокращает жизнь не только у дрожжевого грибка, червяков и млекопитающих, но и у человека. И причина очень простая и механистическая. Питательные вещества напрямую и косвенно (через секрецию инсулина) излишне повышают активность пути метаболизма TOR.
Что трудно проверить на людях, так это ведет ли чрезмерное и труднопереносимое ограничение калорийности к еще большему удлинению жизни по сравнению с добровольным CR. Есть свидетельства, что дополнительное CR отодвигает появление возрастных заболеваний у нетучных людей.69,70 Может ли экстремальное CR ингибировать TOR ниже основного уровня? Но то, чего нельзя сделать с помощью CR, можно сделать медикаментозно с помощью ингибиторов TOR.
Выводы
Источником упомянутых парадоксов является предположение, что смерть вызывается накоплением случайных молекулярных повреждений причиненных свободными радикалами. Хотя случайные молекулярные повреждения накапливаются, они не обязательно вызывают старение и смерть, если что-нибудь еще не прервет жизнь раньше. (Сх 6)
Однако, в теории, накопление молекулярных повреждений, вызванных свободными радикалами, в конечном итоге непременно убьет живое существо. И молекулярные повреждения должны накапливаться, так как соматические клетки не чувствуют необходимости полностью устранять повреждение. Соматическим клеткам необходимо оставаться неповрежденными ровно столько, сколько, судя по всему, данный организм проживет.
Другими словами, степень восстановления повреждений должна лишь гарантировать смерть от других причин. Ключевым условием является «смерть от других причин». В дикой природе внешние причины первыми убивают животное. Это не вызывает сомнений.
Устранение случайной смерти у человека и лабораторных животных изобличает старение. Это старение не является старением, вызванным накоплением молекулярных повреждений. Это есть нечто, что лежит между смертью от случайных причин и случайным молекулярным повреждением. Это квазизапрограммированное старение, простое продолжение вызываемого TOR развивающего роста.